
全部
 772
772
 0
0
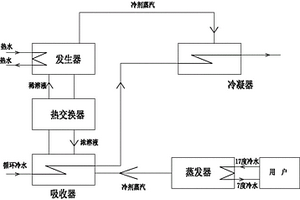
地暖制冷溴化锂机系统及其工作方法,属于地暖再利用技术领域。本发明包括装有溴化锂水稀溶液的发生器和装有溴化锂水浓溶液的吸收器、冷凝器和蒸发器。本发明在现有地暖系统的基础上,对供热机组进行改进,大大降低了资金的投入,且实现了实现资源再利用,提高了设备的利用率。供热机组热水通过溴化锂制冷机组,置换成10℃?16℃的低温水;低温水通过换热站系统进入地暖系统循环,吸收室内热量,使房间降温,房间的温度可保持在20℃??26℃,为人体较为舒适的温度,地暖供冷不使用含氯氟里昂(?CFCs), 以低温水为介质,无臭、无毒、无害,没有环境污染。

 1099
1099
 0
0
本发明为一种高倍率的锂离子电池负极材料及其制备方法。一种高倍率的锂离子电池负极材料的制备方法,包括:(1)将无机锂盐、硝酸化合物、有机氮化合物及添加剂加到水中并混匀,得溶液A;(2)制备掺杂稀土化合物的多孔石墨复合材料B;(3)将所述的多孔石墨复合材料B加入到所述的溶液A中,并加入氧化石墨烯溶液,混匀后、过滤、洗涤、真空干燥,得无机锂盐包覆石墨复合体;(4)采用电化学沉积法,以无机锂盐包覆石墨复合体作为工作电极进行扫描,洗涤,干燥,高温烧结,粉碎,得到所述的锂离子电池负极材料。本发明的技术方案,可以提升首次效率,以及石墨的快充能力,并兼顾能量密度及其高温性能。

 777
777
 0
0
本发明公开了一种新型锂铍浮选调整剂及其制备方法和使用方法,所述锂铍浮选调整剂为:N-甲基脂肪酰胺基乙酸盐;它不但能吸附在表面电位较高的矿物表面,而且能使表面电位较高的矿物从表面电性较低的矿物表面脱离。在易浮作业添加本发明新型锂铍浮选调整剂,可使锂、铍在易浮杂质中的损失率各降低2-10%,氧化锂精矿品位提高0.5-1.5%;铍回收率提高5~15%。在锂、铍矿物综合浮选回收流程中,加入本发明新型锂铍浮选调整剂,可以提高锂精矿品位,降低铍矿物在锂精矿中的损失率;具体来说,可使锂回收率提高2~10%,氧化锂品位提高0.5~1.5%;铍回收率提高5~15%。
 1081
1081
 0
0
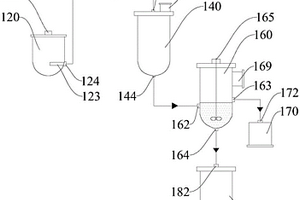
一种生产金属锂的设备及工艺,涉及化工领域。其中,生产金属锂的设备包括化料炉、供料炉、蒸馏炉、收集炉和纯锂炉,通过在蒸馏炉中设置搅拌装置、在化料炉中设置过滤装置以及采用真空抽吸输送锂液的方式,降低了金属锂生产过程中的能耗,延长了设备使用寿命;采用生产金属锂的工艺,既可以降低能耗(降低成本),延长设备使用寿命,又可以提高金属锂的产能,这对于企业占有电池级金属锂市场具有重要作用。
 825
825
 0
0
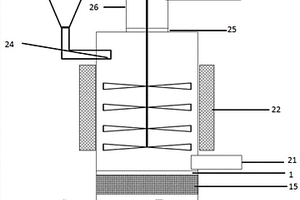
本发明提供了一种用于改性富锂正极材料的设备和方法。该设备包括:腔体;孔状隔离件,孔状隔离件设置于腔体内,并将腔体分隔为第一子腔和第二子腔;进料口,进料口与第一子腔连通以将富锂正极材料加入第一子腔;第一进气口,第一进气口与第二子腔连通以提供使富锂正极材料处于流化状态的气体;容纳部,容纳部设置于第二子腔内,用于容纳脱锂剂;第一加热装置,用于对脱锂剂加热以使脱锂剂产生脱锂气体与富锂正极材料接触进行表面改性。采用本发明的设备对富锂正极材料以流化方式进行改性,提高了介质间的传质速率和传质效果,进而能够得到均匀改性的富锂正极材料。
 773
773
 0
0
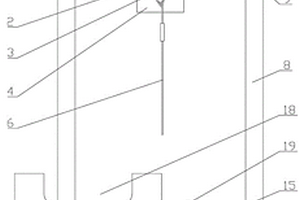
本实用新型涉及一种锂锭切割装置,包括支架、切割装置和剪切模具,支架下部设有能够固定锂锭的剪切模具,对应剪切模具上方位置的支架上部中央设有能够切割锂锭的切割装置,切割装置包括驱动机构、固定板和切割钢丝,支架上侧中央固定安装有驱动机构,驱动机构内设有能上下移动的活塞杆。本实用新型结构合理而紧凑,操作简单,能够通过驱动机构使活塞杆向上移动,带动切割钢丝完成对锂锭的切割,切割后的产品端面平整,通过前固定柱和后固定柱,能够可靠的固定切割钢丝,避免在切割过程中切割钢丝在两头断裂,通过剪切模具,能够便于锂锭切割时定位,提高成品率和工作效率。
 1199
1199
 0
0
本发明提供了一种含有磺酸酯基团的四氟磷酸锂电解液添加剂和含有其的电解液、锂离子电池及设备。本发明电解液添加剂中包含式(I)化合物其中,n为1~10的整数;R1为氢,C1~C50的烷基,C3~C50的环烷基,C2~C50的烯基,或者C6~C50的芳基中的任一种;其中,当R1不为氢时,R1上任意的氢原子可任选的被取代;当n大于1时,R1可以为相同或不同。本发明添加剂化合物中,含有带有磺酸酯基团的四氟磷酸锂,以及磺酸内酯和LiPF6的化学结构,能够在锂离子电池的负极和正极表面形成更稳定的钝化膜,使得锂离子电池在高温下具有良好的循环性能和容量恢复率,较低的电池内阻有利于电池低温性能的改善。
 905
905
 0
0
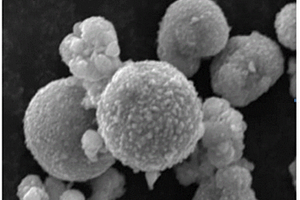
本发明提供了一种富锂锰基改性材料及其制备方法与正极材料,涉及电池材料领域,该富锂锰基改性材料,包括:如式Ⅰ所示的富锂锰基材料和如式Ⅱ所示的具有尖晶石型结构的包覆层;其中,式Ⅰ为:Li1.2MnaNibCo0.8‑a‑bO2,0﹤a≤0.1,0﹤b≤0.1;式Ⅱ为:LiMn2‑xMxO4,0≤x≤0.1,M为二价或三价掺杂金属,以缓解现有在将富锂锰基材料用于锂离子电池时,存在的锂离子电池的倍率性能差和循环过程中电压降大的技术问题,达到提高锂离子电池的倍率性能和降低电压降的目的。
 1061
1061
 0
0
本发明涉及碘化锂技术领域,是一种电池级无水碘化锂及其制备方法;按下述步骤进行:第一步,碳酸锂或单水氢氧化锂中的锂和氢碘酸中的碘按摩尔比为1 : 1计,将碳酸锂或单水氢氧化锂加入氢碘酸中混合均匀后得到第一混合液;第二步,在第一混合液中加入除杂剂并混合均匀得到第二混合液。本发明得到的电池级无水碘化锂的含水量低于现有方法合成的碘化锂的含水量,与现有方法相比,在本发明中不需要干燥氢气、液氨或过量的铁粉等,从而大大降低了生产成本;本发明的制备过程简单、不需要苛刻的工艺条件、操作易控制;同时对有机溶剂进行了回收循环使用,整个过程没有三废产生,对环境无污染,能够工业化生产。
 792
792
 0
0
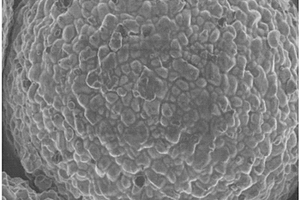
本发明提供了一种改性富锂锰基材料、其制备方法及应用。该制备方法包括以下步骤:将富锂锰基粉末与纳米WO3粉末进行固相混合,得到混合粉;对混合粉进行烧结处理,得到改性富锂锰基正极材料。利用本发明提供的该方法制备的改性富锂锰基材料,其具有富锂锰基材料—WO3核壳结构,纳米WO3粉末在富锂锰基材料表面形成了较为均匀无絮状团聚物的包覆层,包覆层较为致密,且与富锂锰基材料之间的结合性较好,使得该材料具有良好的稳定性。以上原因使得本发明制备的改性富锂锰基材料非常适合作为锂电池正极材料使用,电池的循环电压衰减问题明显改善,循环寿命长。

 862
862
 0
0
本发明涉及氟化锂技术领域,是一种电池级高纯氟化锂及其制备方法;该电池级高纯氟化锂按下述方法得到:将电池级单水氢氧化锂加入到去离子水中配成含锂25克/升至30克/升的氢氧化锂溶液,在氢氧化锂溶液中加入氢氟酸进行反应并调节溶液的PH值为6至7.5,静置10分钟至30分钟后进行固液分离,在分离的固相中加入固相体积的2倍至4倍的去离子水进行洗涤3次,将洗涤后的固相干燥至固相中的质量百分含水量小于0.03%,得到电池级高纯氟化锂。本发明以工业级单水氢氧化锂为原料,经过提纯得到电池级单水氢氧化锂,保证了电池级高纯氟化锂产品的纯度,制备过程中的母液和洗液均可循环利用,从而大大降低了生产成本。
 694
694
 0
0
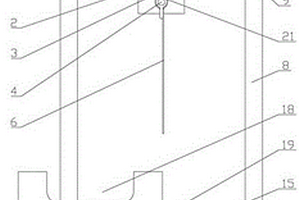
本发明涉及石油化工油田钻井称量技术领域,是一种可调间距式锂锭切割装置,包括支架、切割装置和剪切模具,支架下部设有能够固定锂锭的剪切模具,对应剪切模具上方位置的支架上部中央设有能够切割锂锭的切割装置。本发明结构合理而紧凑,操作简单,能够通过驱动机构使活塞杆向上移动,带动切割钢丝完成对锂锭的切割,切割后的产品端面平整,通过前调节螺栓和后调节螺栓,能够调节切割钢丝的长度,增加本发明的切割范围,通过设置前蝶形螺母和后蝶形螺母,能够便于手动调节切割钢丝的位置和长度,调节方便,通过剪切模具,能够便于锂锭切割时定位,提高成品率和工作效率。
 1147
1147
 0
0
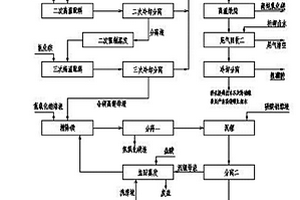
本发明的盐析法盐湖卤水除镁生产碳酸锂、硼酸和高纯氧化镁的方法属于无机盐化工领域,包括镁锂深度分离、精除镁、氯化铵回收三个工序过程。其中镁锂深度分离工序包括一次高温配料、一次冷却分离、一次强制蒸发、二次高温配料、二次冷却分离、二次强制蒸发、三次高温配料、三次分离步骤;精除镁工序包括精除镁、分离一、沉锂、分离二、洗涤、分离三、干燥步骤;氯化铵回收工序包括低温煅烧、尾气回收一、高温煅烧、尾气回收二、冷却分离步骤。本方法生产成本小,系统回收率高,环境污染小,操作方便,可有效提高氧化镁和粗硼酸的纯度,产出合格的碳酸锂和制得纯度较高的氧化镁和粗硼酸。
 1237
1237
 0
0
本发明涉及一种三水碘化锂的制备方法,本发明的方法首先是将单水氢氧化锂溶解在水中,然后加入碘,这样可以使得碘与氢氧化锂更容易反应完全,以提高三水碘化锂的生成率;本发明的方法采用甲酸作为还原剂,反应平稳容易控制,生成的三水碘化锂的纯度高,反应产物为水和二氧化碳,无三废产生,非常环保;加入活性炭吸附杂质,提高了碘化锂的纯度,氢氧化锂与碘反应终点为溶液由无色变为棕色,甲酸还原碘酸锂的终点为溶液的棕色完全褪去,两步反应终点变化明显,碘化锂的制取过程非常容易控制,采用金属钛制作的钛盆蒸发碘化锂溶液,既防止了碘化锂对蒸发器皿的腐蚀又避免了蒸发器皿对碘化锂的污染。
 992
992
 0
0
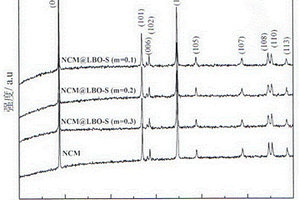
本发明涉及一种改善锂离子电池三元正极材料倍率性能的方法,该方法采用喷雾干燥技术,将锂快离子导体玻璃Li2O‑2B2O3‑mLi2SO4包覆在锂离子电池三元正极材料表面。按照摩尔比的锂化合物、硼化合物、锂硫化合物,加入去离子水,搅拌成均匀浆料,经喷雾干燥制备前驱体,将前驱体置于马弗炉中,在温度500℃下焙烧10h制得样品。该方法提高了锂离子电池三元正极材料在大电流密度下的充放电性能,改善了LiNixCoyMn(1‑x‑y)O2三元正极材料的倍率性能。通过该方法处理的锂离子电池三元正极材料,可有效改善动力电池的快速充放电性能。同时,该方法生产设备简单,生产效率高,成本低,可实现大规模生产。

 924
924
 0
0
本发明公开了一种新型锂铍浮选调整剂及其制备方法和使用方法,所述锂铍浮选调整剂为N甲基9十七烯酰胺基乙基磺酸钠;它不但能吸附在铁矿物表面,而且能使铁矿物从表面电性较低的矿物表面脱离。在易浮作业添加本发明新型锂铍浮选调整剂,可使锂、铍在易浮杂质中的损失率各降低2-10%,氧化锂精矿品位提高0.5-1.5%;铍回收率提高5~15%。在锂、铍矿物综合浮选回收流程中,加入本发明新型锂铍浮选调整剂,可以提高锂精矿品位,降低铍矿物在锂精矿中的损失率;具体来说,可使锂回收率提高2~10%,氧化锂品位提高0.5~1.5%;铍回收率提高5~15%。
 742
742
 0
0
本发明涉及一种负极及其制备方法、以及包括该负极的锂电池。根据本发明的负极,包括:锂负极片;沉积于锂负极片的至少一面的LiF层;沉积于LiF层的LiAlF4层。本发明的锂电池包括本发明的负极。本发明的负极的制备方法,包括步骤:提供锂负极片;采用磁控溅射法在锂负极片的至少一面沉积LiF层;采用磁控溅射法在LiF层沉积LiAlF4层,得到锂负极。根据本发明的负极,既能防止锂枝晶的生长,从而保证了包括本发明负极的锂电池的安全性能;也能保证包括本发明的负极的锂电池具有良好的锂离子电导率。本发明的制备方法,无氟气排放,对反应容器或设备的材质无特殊要求,且保证了锂负极片、LiF层和LiAlF4层的稳定性。

 1069
1069
 0
0
本发明公开了一种泡沫镍集流体磷酸铁锂/石墨烯复合材料电极片的制备方法,涉及电化学技术领域。本发明方法包括以下步骤:将碳酸锂、草酸亚铁、磷酸氢二铵和蔗糖混合烧制成碳包覆的磷酸铁锂前躯体;向所述磷酸铁锂前躯体加入石墨烯进行固相粉体混合,得到磷酸铁锂/石墨烯复合材料;将所述磷酸铁锂/石墨烯、乙炔黑、聚偏氟乙烯和N‑甲基吡咯烷酮溶剂混合搅拌,得到混合浆料;将所述混合浆料滴于三维泡沫镍上制得锂电池正极片;对所述锂电池正极片先进行红外灯照射,再进行真空干燥,最后压片,获得泡沫镍集流体磷酸铁锂/石墨烯复合材料电极片。
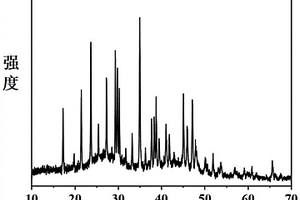
本发明提供一种化合物氟硼酸锂钾和氟硼酸锂钾双折射晶体及制备方法和用途,所述化合物的化学式为Li2KB5O8F2,分子量为273.03,采用固相合成法或真空封装法制成;该晶体的化学式为Li2KB5O8F2,分子量为273.03,属于正交晶系,空间群为Pbcn,晶胞参数为a=8.966(5)Å,b=9.272(8)Å,c=8.247(8)Å,α=90°,β=90°,γ=90°,单胞体积为709.94(7)Å3,紫外吸收边短于196 nm,双折射率为0.05@1064 nm。采用熔体法,高温熔液法,真空封装法,水热法或室温溶液法生长晶体,该晶体的化学稳定性良好,能够用于制作各种用途的偏光棱镜,相位延迟器件和电光调制器件,例如,格兰棱镜、偏振分束器、补偿器、光隔离器环形器和光学调制器等,在光学和通讯领域有重要作用。
 935
935
 0
0
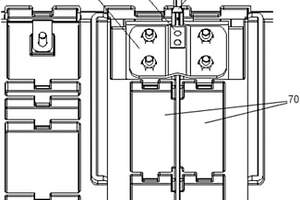
本实用新型涉及用于锂电池电压采集的快插连接自锁结构,其包括用于串联连接电池模块中两个相邻的电池单体的串联铜排、公端子和母端子;公端子包括插片和连接端,连接端与串联铜排连接,插片上设有孔;母端子一端压接导线,另一端设有插槽和设于插槽内的簧片,簧片表面设有与孔配合的凸点,簧片能向背离凸点的方向按压并自动复位。连接时,插片插入插槽,凸点卡入孔中使公端子和母端子实现自锁连接;拆离时,只需要按压簧片解除自锁,使母端子和公端子分开。本实用新型还涉及包含上述快插连接自锁结构的锂电池。本实用新型可实现电池电压采集导线与各电池单体的快速、可靠和稳定连接。 1
 1009
1009
 0
0
本发明涉及一种电解液添加剂、电解液及锂电池,属于锂电池技术领域。电解液添加剂包括结构式Ⅰ所示化合物中的至少一种:所述结构式Ⅰ中R为含有氟基、苯基、烷基、烯基的基团中的一种,其中n为1~5的整数。本发明的电解液添加剂在电解液中发生分解反应,得到的产物在正极表面生成保护膜,起到了钝化作用,抑制了正极材料中金属元素的溶解和正极材料结构的坍塌,提高电解液的电化学稳定窗口,拓宽了电解液的工作电压范围,有效的提高电池在高压下(如4.2~5.0V)的循环效率。
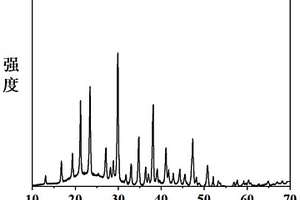
本发明提供一种化合物氟硼酸锂钠和氟硼酸锂钠双折射晶体及制备方法和用途,所述化合物的化学式为Li2NaB5O8F2,分子量为256.92,采用固相合成法或真空封装法制成;该晶体的化合物的化学式为Li2NaB5O8F2,分子量为256.92,属于正交晶系,空间群为Pbcn,晶胞参数为a=8.815(6)Å,b=9.540(6)Å,c=8.300(4)Å,α=90°,β=90°,γ=90°,单胞体积为674.04(10)Å3,采用熔体法,高温熔液法,真空封装法,水热法或室温溶液法生长晶体,该晶体的化学稳定性良好,能够用于制作各种用途的偏光棱镜,相位延迟器件和电光调制器件,例如,格兰棱镜、偏振分束器、补偿器、光隔离器环形器和光学调制器等,在光学和通讯领域有重要作用。
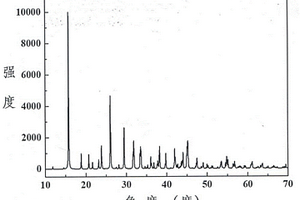
本发明提供一种化合物低温相九硼酸锂锶和九硼酸锂锶非线性光学晶体及制备方法和用途,该化合物的化学式为LiSrB9O15,分子量为431.85,采用固相合成法或真空封装法制成;该晶体的化学式为LiSrB9O15,分子量为431.85,属于正交晶系,空间群为P212121,晶胞参数为a=8.5432(5)Å,b=8.6390(4)Å,c=14.8622(8)Å,α=β=γ=90°,单胞体积为1096.90(10)Å3,晶体的倍频效应约为KH2PO4(KDP)的0.5倍,紫外截止边短于240 nm,采用熔体法,高温熔液法,真空封装法或水热法,该晶体的化学稳定性好,可作为紫外非线性光学晶体在全固态激光器中获得应用。
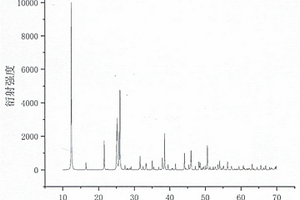
本发明涉及一种化合物氟铝硼酸锂钠和氟铝硼酸锂钠双折射晶体及制备方法和应用。该化合物的化学式为LixNa(1‑x)AlB2O4F2(x=0.4‑0.6),分子量为163.96‑167.17,采用真空封管法合成。该双折射晶体的化学式为LixNa(1‑x)AlB2O4F2(x=0.4‑0.6),分子量为163.96‑167.17,属于单斜晶系,空间群是P21/c,晶胞参数为a=3.6329(3)Å,b=14.1750(12)Å,c=8.3735(10)Å,V=423.39(7)Å3,Z=4。该晶体用于红外‑深紫外波段,为双轴晶体,透过范围为200nm‑3μm;双折射为0.101(1064nm)。采用真空封管法制备晶体,该方法具有制备简单,生长周期短,所使用的起始原料毒性低,物化性质稳定等优点。可用于制作偏振分束棱镜,相位延迟器件和电光调制器件等。
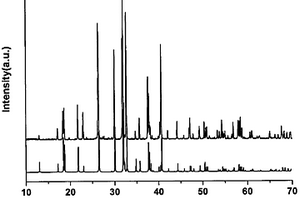
 1120
1120
 0
0
本发明涉及一种化合物锂钾磷氧和锂钾磷氧晶体及其制备方法,该化合物的化学式为LiK3P2O7,分子量298.18;该晶体的化学式为LiK3P2O7,分子量298.18,不具有对称中心,晶体属正交晶系,空间群C2221,晶胞参数为Z=4,采用固相反应法合成化合物及高温熔体法生长晶体,由于化合物LiK3P2O7是同成分熔融,适合使用熔体法生长单晶,而且该化合物熔点低、粘度小,利于熔体中的离子传输,又不需要使用助熔剂,操作简单,生长速度快,成本低,容易获得大尺寸、高质量晶体等优点。本发明的LiK3P2O7晶体的生长周期仅需几天,所得的晶体具有光学均匀性好,物理化学性质稳定,硬度适中,易于切割、抛光加工和保存等优点。
 928
928
 0
0
本发明涉及一种电解液添加剂、锂电池电解液及锂电池,属于锂电池技术领域。添加剂包括式Ⅰ所示化合物中的至少一种:其中,R1、R2、R3均选自烯基、芳香基、碳原子数为C1~C13的烷基、碳原子数为C1~C13的卤代烷基中的一种。本发明的电解液添加剂与有机溶剂相比具有更高的氧化性,在正极表面能优先发生电化学氧化,在正极表面形成SEI保护膜,从而有效抑制电解液中的有机溶剂在循环过程中发生氧化分解及对正极材料结构的破坏,拓宽电解液的电化学窗口,扩大了电池的工作电压范围,尤其是提高了电池在高压(如4.5~5V)下的循环稳定性。

 886
886
 0
0
本发明公开了一种新型锂离子二次电池钛酸锰(III)锂正极材料的制备方法,属于化学材料制备技术领域。本发明以醋酸锂、醋酸锰、钛酸丁酯为原料,柠檬酸(或葡萄糖)为碳源,以有机醇为分散剂得到溶胶-凝胶,然后得到碳包覆的钛酸锰(II)锂(Li2MnTiO4)正极材料的方法。在本发明通过有机醇为分散体系的溶胶-凝胶法固相发合成了的碳包覆钛酸锰(II)锂,所得的碳包覆的钛酸锰(II)锂在0.5C放电比容量最高可达到238.2mAh/g,50周仍然保持在216.3mAh/g以上放电容量。本发明使用的原料简单易得,成本低,制备工艺简单适合于大规模生产。

本发明公开了一种锂离子二次电池用的钛酸锰(III)锂正极材料的制备方法,属于化学材料制备技术领域。本发明以碳酸锂、三氧化二锰、二氧化钛为原料,葡萄糖为碳源,通过调节微波固相仪的功率、升温时间、恒温时间等参数,直接得到碳包覆的钛酸锰锂(LiMnTiO4)正极材料的方法。在本发明通过微波固相发合成了碳包覆的钛酸锰锂,所得的碳包覆的钛酸锰锂纯度高,0.5C放电比容量最高可达到148.2mAh/g左右,100周仍然保持在135mAh/g以上放电容量。本发明使用的原料简单易得,成本低,制备工艺简单适合于大规模生产。
北方有色为您提供最新的新疆有色金属理论与应用信息,涵盖发明专利、权利要求、说明书、技术领域、背景技术、实用新型内容及具体实施方式等有色技术内容。打造最具专业性的有色金属技术理论与应用平台!

